No esboço da Tabela Periódica abaixo estão discriminados os números de nêutrons dos isótopos mais estáveis de alguns elementos.
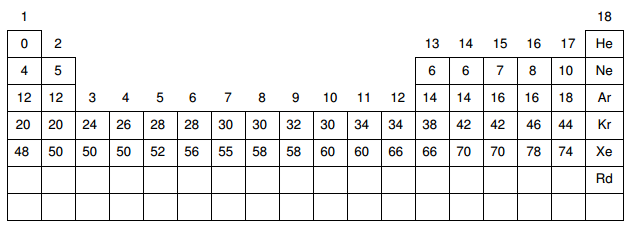
Considere agora um composto iônico binário, em que:
(i) o cátion, de carga +2, possui 12 prótons;
(ii) o ânion, de carga –3, possui 10 elétrons.
A massa de 1 mol deste composto é aproximadamente igual a:
a) 38 g
b) 100 g
c) 122 g
d) 90 g



Como você sabia que o número de Neutrons(n) era 12 e 7?
ResponderExcluirPois, não necessariamente o número de N é igual á quantidade de Protons/Número atômico..
Por favor, ajude , fiquei com muita dúvida nessa questão..
Através da tabela, já que ela organiza os elementos em ordem crescente dos números atômicos.
ExcluirUe mas ele fala que colocou em ordem do número de nêutrons
ExcluirPor que ali é multiplicado por 2 e por 3?
ResponderExcluirOI, POIS QUANDO VOCÊ FAZ O CRUZADO ENTRE OS ELEMENTOS FICA X(3) E Y(2), CERTO?
ResponderExcluir24 É A MASSA DO X E NO CRUZADO O NÚMERO DE ELÉTRONS FICOU 3, POR ISSO A MULTIPLICAÇÃO POR 3(NÚMERO DE ELÉTRONS. A MESMA COISA COM Y.
CONCORDA COMIGO QUE A MASSA MOLAR SERÁ A MULTIPLICAÇÃO DOS ELETRONS E DOS PROTÓNS E NEUTROS( QUE NA VERDADE É A MASSA DE X(24) E Y(14):
A(MASSA)= P+N
OU SEJA, TODAS ESSES ELEMENTOS FAZEM PARTE DA MOLÉCULA, CERTO?
Assim, para encontramos sua massa basta multiplicarmos todos esses elementos.